-
Продукти
- Лабораторни инструменти
- Лабораторни измервателни уреди и сонди
-
Онлайн анализатори
EZ Series Analysers
- Iron
- Aluminium
- Manganese
- Phosphate
- Chloride
- Cyanide
- Fluoride
- Sulphate
- Sulphide
- Arsenic
- Chromium
- Copper
- Nickel
- Zinc
- Ammonium
- Total Nitrogen
- Total Phosphorus
- Phenol
- Volatile Fatty Acids
- Alkalinity
- ATP
- Hardness
- Toxicity
- Sample Preconditioning
- Boron
- Colour
- Nitrate
- Nitrite
- Silica
- Hydrogen Peroxide
- EZ Series Reagents
- EZ Series Accessories
- EZ sc Series Inorganics
- EZ sc Series Metals
- EZ sc Series Nutrients
-
Онлайн сензори и контролери
Датчици за pH и окислително-редукционен потенциал (ORP)
- 1200-S Redox
- 1200-S pH
- 12мм pH/Redox
- LCP pH/Redox
- Дигитален диференциален Redox
- Дигитален диференциален pH
- Диференциален pH
- Комбинация pH/Redox
- Химически вещества, реактиви и стандарти
- Автоматизирани лабораторни системи
- Тестови комплекти и ленти
-
Микробиология
Аксесоари и химикали Дехидратирана средаЛабораторни съдове
-
Лабораторно оборудване и запаси
Ръководства и справочни материали Стъклени съдове/Пластмасови съдове
- Claros Water Intelligence System
- Electrochemistry
- Параметри
-
Софтуерни решения
-
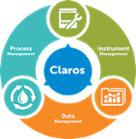
Интелигентната система за вода Claros
Основни елементи на продукта Process Management
- Решения за:
- Отстраняване на BOD/COD
- Нитрификация/денитрификация
- Отстраняване на фосфора
- Управление на утайките
Data Management- Решения за:
- Събиране
- Визуализация и анализи
- Отчитане
- Точност на данните
Instrument Management- Решения за:
- Техническо обслужване
- Отстраняване на неизправности
- Дистанционен достъп
- Сравнение на лабораторните и технологичните данни
Предизвикателства пред индустрията Съответствие с нормите Намаляване на разходите Дистанционни операции Управление на данните Оптимизация на процесите Техническо обслужване на оборудването
-
Интелигентната система за вода Claros
- Индустрии
- Сервиз
- Новини
България
Изберете вашата държава или регион:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
- Vietnam
Middle East - Africa
КАРИЕРИ +359(0)2-963 44 54
Амоняк и амоний
Какво представлява амонякът?
Амонякът е безцветно, газообразно съединение с остра миризма на водород и азот (един азотен атом и три атома водород, NH 3), което е силно разтворимо във вода.
Амонякът се образува естествено като продукт на микробиологичното разпадане на азотни органични вещества (животински и растителен протеин). Също така може да се произвежда и за използване в торове или за производство на пластмаси, фармацевтични продукти и други химикали.
Амонякът е обичайна съставка в подземните води поради микробиологичните процеси. Въпреки това наличието на амонячен азот в повърхностните води обикновено означава замърсяване от битови отпадъци. Излишният амоняк може да увреди растителността и е изключително токсичен за водните организми, особено при повишени нива на рН и температура.
Амонячна вода
За различни приложения амонякът се разтваря във вода, за да се получи „амонячна вода“. Водните разтвори на амоняка (амонячна вода) са нестабилни и концентрацията на амоняк може да намалее по време на транспортиране или по време на съхранение. Следователно доставените разтвори се таксуват въз основа на концентрацията на амоняка, доставен до съоръжението или крайния потребител.
Какво представлява амоният?
Амоният е съединение, което се състои от един атом азот и четири атома водород (NH 4 +). Докато амонякът е неутрална нейонизирана молекула (слаба основа), амоният е йон, носещ положителен заряд. Освен това амонякът излъчва силна миризма, но амоният изобщо не мирише.
Основният фактор, който определя съотношението амоняк – амоний във вода, е рН. Активността на амоняка също се влияе и от йонната сила и температурата на разтвора. Важно е да запомните, че докато молекулярният амоняк може да бъде вреден за водните организми, то амониевият йон по принцип е безвреден. Във водната индустрия е важно да се знаят концентрациите на водородните съединения на азота. Следователно термините амоняк и амоний се използват взаимозаменяемо, изобразени като NH 3 -N или NH 4 -N съответно и обикновено изразени в mg/L или PPM на N.
Химичното уравнение, което показва връзката между амоняка и амоният е:
NH 3 + H 2O <-> NH 4 + + OH -
Когато рН е ниско, равновесието се премества надясно, а когато рН е високо, равновесието се премества наляво. Като цяло при стайна температура с рН, по-малко от 6, частта амоняк-N като NH 3 е много ниска и почти целият амонячен азот присъства като NH 4 +. При рН около 8 частта на NH 3 е 10 процента или по-малко, а при рН малко над 9 е около 50 процента. Когато рН е > 11, всички амониеви йони в разтвора ще бъдат превърнати в молекулярна форма на амоняка. Активността на амонячната вода е много по-ниска при ниски температури.
Защо да следим амоняка?
Амонякът се използва както като реактив, така и като параметър за измерване в няколко области на пречистване на водите и на отпадъчните води.
- За естествено срещащия се амоняк се следи във водоизточника.
- По време на процеса на дезинфекция с хлораминиране амонякът се комбинира с хлор с цел третиране на питейната вода и поддържане на по-дълготраен остатък в разпределителните системи.
- Понякога амонякът се използва за контрол на рН, например във фармацевтичната индустрия.
- Амонякът се следи широко в процесите на нитрификация и денитрификация на отпадъчните води.
Въпреки че обикновено е безвреден при ниски концентрации, високите концентрации на амоняк могат да причинят щети и да представляват риск за здравето. Следователно нивата на амоняк трябва да се следят по подходящ начин и да се поддържат.
В Hach ®, ще намерите оборудване за изпитване, ресурси, обучение и софтуер, необходими за успешното следене и управление на нивата на амоняк във вашето конкретно приложение.
Препоръчани продукти за следене на нивата на амоняк
Hach предлага много от водещите спектрофотометри на пазара за анализ на вода.
Купи сегаЛесните за употреба, здрави, преносими инструменти на Hach са създадени, за да се справят с уникалните напрежения, налични в полето.
Купи сегаСерията HQ е за специалисти по качество на водата, които искат да извършват електрохимически анализ в полеви условия и лабораторна среда.
Купи сегаОнлайн анализаторът Amtax sc на Hach с чувствителен на газ електрод е предназначен за високопрецизно определяне на концентрацията на амоний директно в процеса на пречистване (външни инсталации).
Купи сегаОнлайн анализаторите от серия EZ предлагат множество опции за следене на нивата на амония във вода.
Купи сегаЦифровата йон-селективна сонда A-ISE sc на Hach е предназначена за определяне на концентрацията на амоний директно в средата.
Купи сегаКомбинираният цифров сензор AN-ISE sc на Hach за амоний и нитрат извършва непрекъснато директни измервания чрез йон-селективен електрод.
Купи сегаSL1000 - PPA Portable Parallel Analyzer- Portable Colorimeter with USB
Преносимият паралелен анализатор (PPA) SL1000 на Hach извършва същите тестове с по-малко от половината стъпки, изпълнявани ръчно.
Купи сегаHach е посветен на предоставянето на висококачествени реактиви за рутинен и предизвикателен анализ на водата.
Купи сега
Кои процеси изискват следене на нивата на амоняк?
Пречистване на питейна вода
С газообразния амоняк и неговите концентрирани разтвори трябва да се борави внимателно и в съответствие с изискванията на OSHA (или друга съответна регулаторна агенция). Това се дължи на силно корозивните му свойства, които представляват сериозни рискове за здравето, вариращи от леко дразнене на очите или кожата до химическо изгаряне в зависимост от концентрацията. Освен това амонякът без газове може да причини естетически проблеми, като например неприятен вкус или мирис.
Когато амонякът не се използва за дезинфекция, неговото присъствие в разпределителна система може да означава излугване от материали, използвани в тръбопроводната конструкция, или замърсяване на водата поради повреда в системата. Когато нежеланият амоняк се комбинира с хлор, той намалява дезинфекционната сила на хлорирането.
Хлораминиране
В някои процеси за дезинфекция амонякът умишлено се комбинира с хлор, за да се получи монохлорамин. Въпреки че свободният хлор е по-мощен дезинфектант, монохлораминът (свързан амоняк и хлор) има по-силни остатъчни вещества, така че остава в разпределителната система по-дълго, като по този начин се гарантира, че дезинфекцията се поддържа до крана на чешмата. Освен това хлорамините взаимодействат по-малко интензивно с различни примеси в непречистената вода, особено с органични вещества, като по този начин свеждат до минимум образуването на някои странични канцерогенни дезинфекционни продукти (DBP). За да се оптимизира процесът на хлораминиране, е важно да се следи образуването на целевите дезинфектанти, като същевременно се предотвратява образуването на по-малко желания дихлорамин или трихлорамин (азотен трихлорид). Тестването на монохлорамин се използва заедно с определяне на свободен амоняк, за да се гарантира образуването на правилния дезинфектант и да се намалят разходите за суровини чрез предотвратяване на прекомерното подаване на хлор и/или амоняк.
Научете повече за хлораминирането.
Свободен амоняк
Амонякът, който не се е свързал с хлор по време на дезинфекцията с хлораминиране, се нарича свободен амоняк(и двете NH 4 + и NH 3). При неутрално pH и стайна температура почти целият свободен амоняк съществува като NH 4 +. Тъй като pH и температурата нарастват, количеството NH 3 се увеличава, а количеството NH 4 + намалява. Когато хлораминираната вода се изпусне, нивата на свободния амоняк се увеличават, тъй като монохлораминът взаимодейства с различни органични вещества и бактерии във водата на разпределителната система, задоволявайки потребността от хлор. Повишените нива на свободен амоняк показват началото на нитрификацията. Внезапният спад на свободния амоняк предполага, че е в процес на нитрификация и се образува нитрит. Стойността на свободния амоняк е полезна при определянето на количеството свободен хлор, необходимо за увеличаване на остатъчния монохлорамин в бустер станция. Нивото на свободен амоняк може да бъде намалено чрез добавяне на свободен хлор в съотношение 5:1 като Cl 2:N, за да насочва процеса и да помогне за минимизиране на вероятността за нитрификация.
Общ амоняк
Общият амоняк е сумата от целия амонячен азот, присъстващ под формата на монохлорамин (NH 2Cl), други хлорамини, амониев йон (NH 4 +), и молекулярен амоняк (NH 3). Този параметър може да служи като първична или вторична проверка за поддържане на процеса на хлораминиране под контрол.


Пречистване на повърхностни/подземни води
Амонякът се образува като страничен продукт, когато бактериите разграждат естествените материали в почвата. Високите концентрации на амоняк могат да бъдат причинени от богата на желязо почва, в близост до гора или тор и фекално замърсяване.

Пречистване на отпадъчни води
По време на пречистването на отпадъчните води нивата на амоняк могат да достигнат изключително високи концентрации в резултат на бактериалното действие. Амонякът първо се превръща в нитрат чрез процеса на нитрификация, така че може да бъде редуциран до атмосферен азот(N 2) чрез денитрификация. Научете повече за пречистването на битовите отпадъчни води.. При високи концентрации и високо рН амонякът може да бъде токсичен за микробите за разграждане на утайка. Освен това, за да се предотвратят увреждания на водните организми, от решаващо значение е да се следи и отстранява амонякът от отпадъчните води, преди да бъде изпуснат в естествените водоеми.

Аквакултура
Като отпадъчен продукт от водните организми амонякът може да бъде токсичен за рибите и водните растения при нива от 0,5 mg/L. В създадените аквариуми амонякът може бързо да се превърне в нитрит и евентуално в нитрат. Повечето аквариуми се стремят да постигнат нулево количество амоняк.
В естествена водна среда високите нива на амоняк могат да доведат до излишък от растеж на водорасли, който блокира слънчевата светлина, влошавайки зрението и фотосинтеза.

Селско стопанство
Тъй като растенията не могат да фиксират азота директно от атмосферата, те разчитат на азотфиксиращи бактерии, за да превърнат азота в амоняк. Тогава азотът под формата на амоняк може да се използва от растенията за създаване на други основни органични молекули, необходими на сложните организми. За да подпомогне или да подобри този естествен процес (който е част от азотния цикъл), амонякът често се добавя към торовете. Например хидропонните хранителни разтвори въвеждат азот под формата на амонячна сол. Амонякът може също да присъства в почвата поради дозиране на урея и нейното последователно разлагане.

Фармацевтична промишленост
Във фармацевтичната индустрия амонякът се използва за контрол на рН, а неговият разтвор се използва за регенериране на слаби йонообменни смоли и за регулиране на рН.
Как се следи амонякът?
Салицилатен метод
Салицилатният метод е разновидност на добре познатия фенатен метод, но има предимството, че не съдържа живачни соли и фенол. Този метод е най-полезен за определянето на амонячен азот с нисък обхват. Въпреки че процедурата включва множество стъпки, преди да бъде получен окончателният зелен цвят, всички реактиви се съдържат в удобни прахообразни възглавници (възглавници от салицилатен реактив на прах и възглавници от алкален цианурат на прах) или комбинация от възглавници на прах и флакони с TNT.
- Амонячните съединения реагират с хипохлорит, образувайки монохлорамин.
- След това монохлораминът взаимодейства със салицилата, за да се образува 5-аминосалицилат.
- Окисляването на 5-аминосалицилата се извършва в присъствието на катализатор, нитропрусид (наричан още нитроферицианид), което води до образуването на индосалицилат, съединение със син цвят. Синият цвят е маскиран от жълтия цвят (от излишния нитропрусид), поради което се получава разтвор със зелен цвят. Интензитетът на получения зелен цвят е пряко пропорционален на концентрацията на амоняк в пробата.
Отпадъчни води или
|
Хлораминиране |
|
Настолен: Метод с прахообразни възглавници 8155 Преносим: DR300 Амоняк Комплект тестове за амоняк, NI-SA Тест-ленти за определяне на амоняк Онлайн: |
Преносим: Реактиви Chemkey за свободен амоняк и монохлорамин DR300 Монохлорамин/Свободен амоняк Настолен: DR3900 Спектрофотометър за анализ на монохлорамин/свободен амоняк Онлайн: 5500sc Анализатор на амониев монохлорамин |

Чувствителна на газ сонда
Амонячният електрод измерва амонячния газ във водни разтвори или амониеви йони, които са превърнати в газ чрез добавяне на силна основа. Електродът е завършена електрохимична клетка, състояща се от стъклен рН електрод и еталонен електрод. Газопропускливата мембрана отделя пробата от тънък слой електролит, който е притиснат между рН електрода и мембраната. При високо рН амониевият йон се превръща в амонячен газ. Газът дифузира през мембраната и причинява промяна на рН в тънкия слой електролит. Потенциалът на рН стъклото се променя в резултат на промяната на рН и електродът измерва промяната в потенциала. Измерената промяна на pH е пропорционална на концентрацията на амоняк в разтвора.
Настолен/Преносим:
IntelliCAL ® ISENH3181 амонячен (NH3) йон-селективен електрод (ISE)
Онлайн:
Метод на Неслер
При теста за амоняк реактивът на Неслер (K 2HgI 4) взаимодейства с амоняка, присъстващ в пробата (при силно алкални условия), за да се получи жълтооцветен вид. Интензивността на оцветяването е правопропорционална на концентрацията на амоняка.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
Настолен:
Преносим:
Комплект тестове за амоняк NI-8
Онлайн:
Често задавани въпроси
Какви методи могат да се използват за докладване на EPA на стойностите на амоняк в отпадъчните води?
Амонячният азот може да бъде измерен с помощта на спектрофотометър (или колориметър) или амонячен йон-селективен електрод (ISE). Представени по-долу методи са приети или еквивалентни на методите за анализ на отпадъчни води на Американската агенция за защита на околната среда (USEPA).
Азотно-амонячен метод на Неслер 8038 -приет от USEPA за анализ на отпадъчните води (изисква се дестилация), Метод 350.2.
Азотно-амонячен TNTplus метод 10205 - еквивалентен
Метод с амонячен йон-селективен електрод (ISE) 10001 и 10002 - Тези процедури могат да се използват за стандартни методи за изследване на вода и отпадъчна вода 4500-NH3 E за докладване на USEPA NPDES.
Защо салицилатни реактиви за TNTplus ® амоняк са еквивалентни на EPA, но салицилатните реактиви за TNT Amver не са?
Комплектите реактиви TNT830, TNT831 и TNT832 за амоняк TNTplus се смята, че са еквивалентни за анализ на отпадъчните води и докладване на Американската агенция за опазване на околната среда (USEPA). Комплектите амонячни реактиви TNT Amver не се считат за еквивалентни за докладване на USEPA.
Hach създаде EPA форматиран метод с успоредни данни за подкрепа, за да следва MUR и еквивалентността на състоянието за амонячните салицилатни реактиви TNTplus ® Това не е направено за по-старите реактиви за салицилат TNT Amver. Ако потребителят иска да обмисли по-старите тестове за TNT амоняк за съответствие с нормативните изисквания, той все още може да го обсъди със своя регулаторен орган.
Еталонен EPA форматиран метод, "TNTplus амонячно-спектрофотометрично измерване на амонячен азот и общ азот по Келдал във вода и отпадъчни води" за информиране за еквивалентност по USEPA за 350.1 и 351.1.
Методът на Неслер и салицилатният метод откриват ли амоняк или амоний?
Както методът на Неслер, така и салицилатният метод се основават на реакция с молекулярен амоняк в основен разтвор. Ако оригиналната проба съдържа амониеви йони, основните реактиви ще я превърнат в молекулярен амоняк и след това тя ще реагира и ще допринесе за крайния резултат от теста. Тези прости тестове за амоняк обаче не включват амоняка, който е в органично свързани аминогрупи. Истинският тест за общ амоняк ще включва хлорамини и ще изисква нагряване на пробата в кисел разтвор с цел разграждане на органичния амоняк.
Тъй като резултатът от теста е сбор от молекулярния амоняк (NH 3) и йонния амоний (NH 4 +), предпочитаната единица за отчитане е като азот (NH 3 -N). Повечето колориметри и спектрофотометри на Hach имат възможност да преобразуват резултатите от теста за азот, амоняк и амоний. Това не променя химията на теста; само променя мерните единици. Трябва да се отбележи, че макар да има същото количество азот в амоняка и в амония, стехиометричните съотношения на N към NH 3 и NH 4 + не са точно равни поради различния брой водородни атоми.
- За да превърнете от 3 -N в mg/L NH 3, умножете по 1,216.
- Изчислено като масата на NH 3 се дели на масата на N (17,034 ÷ 14,01 = 1,216).
- За да превърнете от mg/L NH 3 -N в mg/L NH 4, умножете по 1,288.
- Изчислено като масата на NH 4 + е разделена на масата на N (18.042 ÷ 14.01 = 1.288).
Какво всъщност измерва анализаторът Amtax sc?
Когато измерването се покаже на Amtax sc, мерните единици са "NH 4 -N" или "NH 4",което означава, че измерването на инструмента е изразено като амоний и отчита стойностите като азот (също описано като "NH 4 as N"),или като амоний. Няма разлика в изразите за концентрацията на амоняка ("NH 4 -N" или "NH 3 -N") тъй като и в двата случая тя се изчислява като азот, чието количество е еднакво и за двете форми на амоняка.
Анализаторът Amtax sc добавя натриев хидроксид (NaOH) за регулиране на рН и превръщане на амониевите йони (NH 4 +) в газообразен амоняк(NH 3), който преминава през селективна мембрана за амонячен газ и предизвиква промяна на pH на електролитен разтвор. Тази промяна на pH в електролита се измерва като сигнал в mV, който е пропорционален на концентрацията на амоняк (NH 3) в пробата.
Каква концентрация на амоняк е токсична за рибите?
Амонякът съществува във водата като амониев йон (NH 4 +)или като нейонизиран амоняк (NH 3). Нейонизираният амоняк е токсичен за рибите, докато амониевият йон е нетоксичен, освен при изключително високи концентрации. При неутрално рН 7 и стайна температура почти целият амоняк съществува като NH4+. Тъй като pH и температурата нарастват, количеството NH 3 се увеличава, а количеството NH 4 + намалява.
За да измерите концентрацията на нейонизиран амоняк в проба, следвайте стъпките, представени по-долу:
- Измерете концентрацията на амоняка, като използвате всеки метод за амоняк, с изключение на метода за свободен амоняк.
- Измерете pH и температурата на пробата. Направете справка с таблицата, озаглавена „Процентно съдържание на нейонизиран амоняк във воден разтвор по рН стойността и температурата, изчислени от данните, посочени в Emerson, et. al*“ на стр. 11 в FF2 Ръководство на комплекта за тестване на сладководни аквакултури. .
- Определете процентното съдържание на NH 3, като използвате таблицата, рН на пробата и температурата на пробата.
- Умножете концентрацията на амоняка по процентите от таблицата и след това разделете на 100.